Закон Бойля [23]
Закон Бойля [23] До кінця життя Ван Гельмонта інтерес до газів і особливо до повітря - найбільш поширеній газу несподівано зріс. У 1643 році італійський фізик Еванджеліста Торрічеллі (1608-1647) зумів довести, що повітря чинить тиск. Торрічеллі показав, що повітря може підтримувати стовпчик ртуті висотою в 28 дюймів Так був винайдений барометр. Після цього відкриття гази стали здаватися менш загадковими. Як з'ясувалося, подібно рідин і твердих речовин, вони мають вагу і від рідин і твердих речовин відрізняються головним чином набагато меншою щільністю. Німецький фізик Отто фон Геріке (1602-1686) переконливо показав, що атмосферне повітря має вагу. Геріке винайшов повітряний насос, за допомогою якого повітря викачували з посудини, так що тиск повітря зовні судини ставало більше, ніж усередині. У 1654 році на замовлення Геріке був виготовлений прилад, що складається з двох мідних півкуль (щоб з'єднання було щільним, між півкулями поміщали шкіряне кільце, просочене розчином воску в скипидарі). Поєднавши ці півкулі, Геріке відкачав з отриманого кулі повітря. Зовнішнє повітря тиснув на півкулі і утримував їх разом, так що їх не могли роз'єднати упряжки коней, щосили тягнули півкулі в різні боки. Коли ж Геріке впускав в кулю повітря, півкулі розпадалися самі. Цей досвід увійшов в історію науки як досвід з «магдебурзькими півкулями». Такого роду демонстрації підвищували інтерес до властивостей повітря. Зокрема, вони привернули увагу ірландського хіміка Роберта Бойля (1627-1691). Сконструйований Бойл повітряний насос був більш досконалий насоса Геріке. Освоївши методику відкачування повітря з посудини, Бойль вирішив спробувати зробити зворотне - стиснути повітря. В ході дослідів Бойль виявив, що обсяг даної маси повітря обернено пропорційний тиску (рис. 4). Заливаючи ртуть в дуже довгу трубку особливої U-подібної форми, Бойль замикав пробу повітря в короткому запаяному кінці трубки. Додаючи ртуть в довгий відкритий кінець трубки, можна було збільшити тиск. Коли Бойль додав таку кількість ртуті, при якому тиск на повітря збільшувалася вдвічі (подвоєна маса ртуті), обсяг повітря зменшився також удвічі. Якщо тиск збільшувалася втричі, обсяг зменшувався втричі. У той же час, якщо тиск знижувався, обсяг збільшувався. Відкрита Бойл зворотна залежність обсягу від тиску отримала назву закону Бойля. Перше повідомлення про цей закон було опубліковано в 1662 р Бойль не обмовив особливо, що його закон дійсний тільки при постійній температурі. Можливо, він розумів це і вважав само собою зрозумілим. Французький фізик Едм Маріотт (1630-1684), незалежно від Бойля відкрив цей закон в 1676 р, особливо підкреслював, що така залежність обсягу від тиску спостерігається тільки при постійній температурі. З цієї причини закон Бойля в континентальній Європі часто називають законом Маріотта. Мал. 4. Схема досвіду (а), що показує, що обсяг газу обернено пропорційний тиску при постійній температурі (закон Бойля), і отримана крива залежності обсяг - тиск (б). Ртуть, налита в довге плече U-подібної трубки, замикає повітря в короткому плечі. Зі збільшенням маси ртуті висота стовпчика повітря зменшується. Закон Бойля з'явився першою спробою застосувати точне вимірювання при з'ясуванні причин зміни речовин [24] . Досліди Бойля привернули увагу атомистов, до числа яких належав і сам Бойль. Як вже зазначалося вище, атомистические погляди античних вчених, викладені в поемі Тита Лукреція Кара (див. Гл. 1), поділяли багато європейські вчені того часу. Переконаним атомісти був і французький філософ П'єр Гассенді (1592-1655), під впливом якого прихильником атомістичної теорії став і Бойль [25] . Однак, поки хіміки займалися вивченням тільки рідин і твердих речовин, довести справедливість цієї теорії було надзвичайно важко, і за часів Бойля таких доказів було нітрохи не більше, ніж за часів Демокрита (див. Гл. 1). Рідини і тверді речовини стискаються лише в незначній мірі. Якщо ці речовини і складаються з атомів (матерія дискретна) і атоми в них стикаються між собою, то більше зблизити їх не можна. Якщо ж рідини і тверді речовини являють собою «суцільне» речовина (матерія неперервна), то їх також дуже важко піддати стисненню. Тому довести, що рідини і тверді речовини складаються з атомів, було дуже важко. Як же довести, що атоми існують? На відміну від твердих речовин і рідин повітря, як спостерігали ще в давнину, а Бойль свого часу наочно довів, легко стискається. Пояснити це можна, тільки прийнявши, що повітря складається з найдрібніших атомів, розділених порожнім простором. Стиснення повітря в цьому випадку обумовлено зближенням атомів в результаті стиснення порожнього простору між ними. Якщо гази складаються з атомів, то цілком можна припустити, що рідини і тверді речовини також складаються з атомів. Наприклад, як випаровується вода? В процесі випаровування «зникають» одна за одною найдрібніші частинки води. Зовсім неважко уявити собі, що вода перетворюється в пар атом за атомом. Якщо воду нагрівають, вона кипить, і при цьому утворюється пара. Водяна пара має фізичні властивості воздухоподобного речовини, і, отже, цілком природно припустити, що він складається з атомів. Але якщо вода складається з атомів, будучи в газоподібному формі, то чому вона не може складатися з атомів, перебуваючи в рідкому або твердому (у вигляді льоду) стані? А якщо це справедливо для води, то чому не може бути справедливо для всіх видів матерії? Доводи такого роду справляли враження, і вперше за свою історію двотисячоліття атомізм почав завойовувати прихильників, число яких швидко зростала (наприклад, до атомизму прийшов Ньютон). І тим не менше поняття «атом» залишалося неясним. Про атомах нічого не можна було сказати, крім того, що якщо вони існують, то з їх допомогою простіше пояснювати поведінку газів. Лише через півтора століття атомізм знову привернув увагу хіміків. 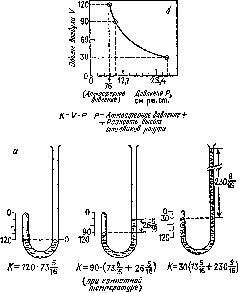
Наприклад, як випаровується вода?
Але якщо вода складається з атомів, будучи в газоподібному формі, то чому вона не може складатися з атомів, перебуваючи в рідкому або твердому (у вигляді льоду) стані?
А якщо це справедливо для води, то чому не може бути справедливо для всіх видів матерії?